1. 서론
우리나라는 병원 수준에서 일회용 의료기기 재처리를 해왔지만, 재사용을 허용하고 있는 미국, 독일, 호주와 달리 일회용 의료기기의 재처리 및 재사용에 관한 규정이나 보건당국의 권고사항이 명시적으로 제시되어 있지 않았다.
일회용 의료기기의 재사용 논란이 사회문제시 되기 시작한 것은 2003년 일회용 자가 무통 조절기를 재사용한 것에 대해 언론에서 보도하면서이며 그 이후에도 간헐적으로 일회용의료기기를 재사용하고 보험 청구 시에는 일회 사용한 금액으로 신청한 사례가 적발되면서 사회적으로 부당청구를 한 사실 뿐만 아니라 일회용 의료기기를 재사용하는 것 자체를 비도덕적으로 다루면서 문제로 대두되었다. 당시 보험권에서는 일회용 치료재료의 수가 중 일부에서 재사용을 전제로 하여 등분 보상하는 경우가 적지 않았으며 일부 치료재료가 행위의 수가에 녹아 있어 일회용의료기기를 재사용하지 않고서는 경제적 손실을 막을 수 없는 등의 건강보험권 내의 현실을 감안할 때 일회용의료기기의 재사용은 보편적인 상황이었다.
2009년 2월 국민권익위원회는 일부 의료기관에 대해서는 ‘의료기관이 재사용하면서 새 제품을 사용한 것처럼 진료비(치료재료비용)를 부당 청구’하고 있음에 대해, 그리고 식약청에 대해서는 일회용 의료기기에 대한 명확한 정의규정이 미비하고 일회용 기준·규격 등에 대한 심사 없이 업체가 신청한 대로 허가 결정하고 있음을 지적하였으며, 일회용 의료기기 재사용 금지에 대한 식약청과 보건복지가족부의 관계 부처 간 입장차이가 상존하고 있음을 언급하였다. 또한 일회용 의료기기는 재사용에 따라 ‘치명적인 2차 감염을 일으킬 가능성’이 있을 것이므로 ‘일회용 의료기기의 기준 확립 및 재사용을 금지’할 것을 권고하는 ‘일회용 의료기기의 진료비 부당청구 방지 제도개선(안)’을 제시하였고 현재 국회에서는 관련 법안의 입법과정 중에 있다.
일회용 의료기기의 재사용에 관한 논란은 우리나라 뿐 아니라 외국에서도 이미 30∼40년간 논란이 이어져왔던 문제로써 법적, 사회적, 윤리적 문제들에 대해 각 나라에서 연구되고 논의되어 왔다. 정책 결정에 있어서 주로 논의 되었던 점은 첫째, 재사용에 따른 환자 감염 발생과 같은 위해의 증가나 재사용된 의료기기의 기능 저하로 인한 시술 실패 증가여부, 둘째, 재사용을 금지함에 따라 고가의 일회용 의료기기의 사용량이 증가하게 되어 보험자뿐만 아니라 궁극적으로 환자의 의료비용 부담의 증가, 셋째로는 사회에서 사용되는 모든 일회용 제품들이 가진 문제로써 쓰레기의 증가로 인한 환경오염의 문제이다.
본 연구는 이러한 일회용 의료기기의 사용과 관련되어 외국의 일회용 의료기기의 재사용에 관한 정책을 검토하고, 의료기술평가를 수행하여 일회용의료기기의 재사용이 안전하고 효과적인지에 대한 현존하는 근거를 제시하고 법적, 사회적, 윤리적 문제들에 대한 논점들을 제시하여 일회용의료기기 재사용 문제에 대한 국가적 제도와 입법과정에 합리적인 정책결정이 이루어지도록 돕고자 한다.
2. 연구 방법
본 연구의 주요 질문은 다음과 같다.
1. 주요국가의 일회용 의료기기의 재사용에 대한 정책은 무엇인가?
2. 일회용 의료기기의 재사용은 임상적으로 안전하고 효과적인가?
3. 일회용 의료기기 재사용에 관련하여 고려해야 할 사회․윤리적 측면은 무엇인가?
위와 같은 연구 질문에 답하기 위해 다음과 같은 방법을 통해 연구가 수행되었다.
첫째, 외국의 일회용의료기기 재사용 관련 보고서 및 자료를 검토하고 필요한 경우 해당 국가의 관계자와의 서신교환을 통해 외국의 정책과 제도를 알아보았다.
둘째, 일회용 의료기기의 재사용의 임상적 안전성 및 효과성에 관한 문헌적 근거를 확인하기 위하여, 기존에 출판된 체계적 문헌고찰을 활용한 의료기술평가방법론을 도입하였다. 현존하는 체계적 문헌고찰을 확인하기 위하여 2000년도 이후에 출판된 체계적문헌고찰과 의료기술평가보고서를 검색하여 연구질문과의 관련성(relevance)에 대한 평가하였으며, 이 중에서 선택된 양질의 체계적 문헌고찰 연구 중 최근에 출판된 것을 최상의 사용가능한 근거(best available evidence)로 채택하였다. 추가로 최상의 사용가능한 근거로 선택된 체계적 문헌고찰 이후에 출판된 국외 일차연구를 체계적으로 검색하였다. 한편, 국내에서 한국어로 출판된 연구들도 체계적으로 검색하여 포함시킴으로써 현존하는 일회용 의료기기에 관한 안전성 및 효과성을 다룬 문헌을 종합 검토하는 고찰(comprehensive review using existing systematic reviews)을 수행하였다. ovidmedline, embase, cochrane library, crd database에서 검색된 국외문헌 86편과 koreamed, kmbase 등에서 검색된 국내문헌 114편 중 사전에 정의된 선택기준에 따라 안전성만을 다룬 체계적 문헌고찰 1편, 안전성 및 효과성을 다룬 체계적 문헌고찰 3편과 국내 일차연구 5편이 평가에 포함되었다.
ovidmedline, embase, cochrane library, crd database에서 검색된 국외 체계적문헌고찰 문헌 86편 및 2007년 이후에 출판된 국외 일차연구 127편, koreamed, kmbase 등에서 검색된 국내문헌 114편 중 사전에 정의된 선택 및 배제기준에 의해 국외 체계적문헌고찰 문헌 4편(안전성만을 다룬 체계적 문헌고찰 1편, 안전성 및 효과성을 다룬 체계적 문헌고찰 3편), 2007년 이후에 출판된 국외 일차연구 8편, 국내 일차연구 5편이 최종 평가에 포함되었다. 두 명의 연구자가 독립적으로 선택기준에 의하여 문헌을 선택한 후 질평가를 수행하였으며 합의하여 결정하였다.
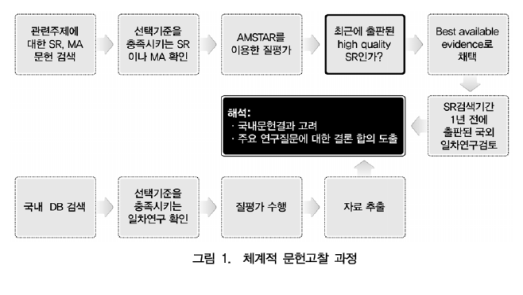
셋째, 기존의 안전성 유효성에 대한 fda의 관점과 이에 대한 gao 보고서를 고찰하여 장기간 다기관에 걸쳐 사용한 결과 유해가 있는지에 대한 관점을 제시하였다.
넷째, 사례연구로써 비교적 국내외 재처리 역사가 깊은 일회용 전기생리학적 진단용 카테터에 대하여 fda와 같이 엄격한 재처리절차를 요구할 때 국내 의료기관에서 시행할 수 있는지 인터뷰를 통해 알아보았고 비용절감의 효과 여부에 대한 사례연구를 수행하였다.
마지막으로 일회용의료기기의 재사용에 관하여 사회, 윤리적 이슈를 다룬 의료기술기술평가보고서와 그 외 윤리적 사회적 이슈를 다룬 관련 문헌들에 대한 고찰을 수행하였다.
3. 국외 현황
일회용 의료기기의 재처리에 대한 각 국가의 입장은 다양하다. 이는 각 국가의 보건의료체계로 인한 차이와 일회용 의료기기의 재사용을 둘러싼 안전성 문제를 보는 시각에 대해서는 상대적인 견해의 차이가 있다. 이러한 차이로 인해 일회용 의료기기의 재처리를 둘러싼 각 국가의 정책은 다르지만 이는 모두 환자의 안전성을 최우선을 보장해야 한다는 전제조건은 동일하다. 일회용 의료기기의 재사용에 대한 각 국가정책은 크게 재처리 전반을 철저하게 관리하면서 재처리를 허용하는 국가가 있는 반면 안전성을 우려하여 재처리를 법적으로 금지하는 국가 혹은 법적 금지까지는 아니더라고 재처리를 하지 않기를 권고하는 국가도 있다. 또한 일회용 의료기기의 재처리가 이루어지고 있음에도 불구하고 현재까지 재처리 관리방안에 대한 공식적인 입장을 제시하고 있지 않은 국가들도 있다(표 1).
표 1. 일회용 의료기기 재사용에 대한 국가별 분류
|
금 지 |
권고하지 않음 |
질적 관리 하에서 허용 |
공식적인 입장이
없음 |
|
프랑스(권고성격), 스페인, 오스트리아, 포르투갈, 캐나다 (마니토바, 노스웨스트 준주), |
영국, 헝가리, 캐나다(뉴 브런즈윅, 온타리오, 알버타, 브리티시 콜롬비아), 이탈리아, 스위스 |
독일, 미국, 호주, 덴마크, 스웨덴, 벨기에, 노르웨이, 네덜란드, 캐나다(퀘벡) |
싱가포르, 일본, 대만, 그리스, 뉴질랜드, 폴란드, 핀란드 |
일회용 의료기기의 재사용을 금지하고 있는 국가에는 프랑스, 스페인, 오스트리아 등이 해당한다. 프랑스는 의료인에 의한 일회용 의료기기의 재처리는 금지하고 있지만 이는 권고적 성격이 강하여 실제 재사용이 이루어지고 있다. 법적으로 금지하고 있는 수준은 아니지만 가능한 한 사용하지 않을 것을 권고하고 있는 국가에는 영국 등이 해당한다. 영국은 재사용된 일회용 의료기기가 안전한지, 원래의 사용목적대로 작동할지에 대한 체계적인 검토가 이루어지지 않았으며 이 상태에서의 일회용 의료기기의 재사용은 결국 불필요한 위험에 의료인과 환자를 노출하는 것이라고 본다. 캐나다의 경우 각 주마다 재사용에 대해 다른 입장을 가지고 있으며, 이 밖에 아직까지 일회용 의료기기의 재사용에 대한 국가차원에서의 공식적인 입장을 가지고 있지 않은 국가들에는 싱가포르, 일본, 대만 등이 있다. 이 국가들에서는 아직 일회용 의료기기의 재사용에 대한 공식적인 결정을 내리지 못한 상황으로 체계적인 관리 없이 현재 재사용이 이루어지고 있는 실정이다.
일회용 의료기기의 재사용으로 인해 발생할 수 있는 위험을 철저한 질적 관리를 통하여 예방할 수 있다고 판단한 국가들은 재사용을 허용하고 있다. 재사용을 허용하고 있는 대표적인 국가에는 미국, 독일, 호주 등이 있다. 독일은 적절하게 입증된 절차에 따라 재사용을 시행한다면 법적으로 허용하고 있으며, 재처리에 관련된 robert koch institute의 권고안을 두고 세부적인 사항을 규정하고 있다. 호주 역시 이와 유사한 정책으로 식약청(tga)의 기준을 충족하는 시설에서만 일회용 의료기기의 재처리를 허용하고 있다.
미국은 2002년 일회용 의료기기의 재처리 관련 법안(mdufma) 입법 후 2006년까지 지속적인 세부적인 규정 수정이 이루어져왔다. fda의 여러 지침을 통해 일회용 의료기기의 재처리와 관련된 세부 규정을 확인할 수 있는데, 일회용 의료기기를 재처리하기 위해서는 재처리업자로 등록해야하며 재처리하고자 하는 의료기기 목록을 제출해야 한다. 또한 일회용 의료기기에 따른 부작용 보고, 의료기기 추적, 수정 및 제거, cgmp에 의거한 질관리, 라벨링, 시판전 고지, 밸리데이션 입증 등의 의무 사항을 지켜야 일회용 의료기기를 재처리할 수 있다. 일회용 의료기기를 재처리하려면 의료기관 역시 산업체와 같은 요건을 요구받기 때문에, 미국에서는 전문 산업체들이 주로 일회용 의료기기 재처리를 하고 있다. 시판전 고지(510k)를 거친 일회용 의료기기만이 재처리되고 있으며, 규정된 적절한 절차를 통해 일회용 의료기기를 재사용하는 것을 허용하고 있다.
4. 일회용의료기기의 안전성 및 효과성에 대한 근거
4.1 의료기술 평가
일회용 의료기기의 재사용에 관한 임상적 효과성에 대한 결론은 2004년 nzhta(new zealand health technology assessment)보고서와 2008년 cadth(canadian agency for drugs and technologies in health)에서 포함된 일차문헌을 종합적으로 검토한 후 추가로 검색된 일차연구를 평가한 2009년 aetmis(agence d'evaluation des technolgoies et des modes d'intervention en sante)의 의료기술평가보고서의 결론을 최근의 사용가능한 근거로 채택하였다. 또한 추가로 검색된 국내문헌 5편은 혈액투석막과 미세각막절개시 일회용 칼날에 관한 연구로 혈액투석막의 연구결과는 기존의 체계적 문헌고찰 연구결과와 일치하였다. 2007년 이후에 출판된 국외 일차 연구 5편에서 추가로 연구된 의료기기는 진단용 초음파 카테터, 관절경 shaver blade, sterile polymer sheath이었다. 2009년 aetmis의 근거 판단 기준을 토대로 하여 본 연구에서 검토된 전체 20개의 일회용 의료기기(critical 의료기기 15개, semi-critical 의료기기 5개)의 재사용에 관한 임상적 안전성 및 효과성에 관한 근거는 다음과 같이 분류될 수 있다.
|
의료기기 종류 |
근거 요약 |
|
critical |
ptca 카테터 |
b |
|
balloon 카테터 |
c |
|
전기생리학적 카테터 |
b |
|
중심정맥 카테터 |
c |
|
일회용 혈관경 |
c |
|
아르곤 빔 응고 탐색자 |
c |
|
관류 삽입관 |
c |
|
일회용 플라스틱 트로카/ 일회용 복강경 도구들 |
b |
|
혈액투석막 |
a |
|
괄약근 절개기 |
b |
|
수정체 유화법 needle tip |
c |
|
생검용 포셉 |
d |
|
미세각막절개시 일회용 칼날 |
c |
|
진단용 초음파 카테터(acunav- catheter) |
c |
|
관절경 shaver blade |
c |
|
semi-critical |
외고 고정 장치(components of orthopedic external fixator) |
b |
|
호흡기 circuit 필터(breathing circuit filter) |
c |
|
기도 유지 기기 |
c |
|
기관지경 stopcocks |
c |
|
sterile polymer sheaths |
c |
a : 안전하며 효과적이라고 결론내리기에 충분한 근거가 있음
b : 실험실 연구에서 엄격한 재처리 표준을 따른다면, 재사용은 안전한 것으로 보여짐
하지만 잘 설계된 인간 대상 임상연구가 더 필요함
c : 적은 수의 실험실 기반 전후 연구로 결론내리기에 자료가 불충분함
d : 실험실연구에서 수행된 모든 연구에서 재처리된 이후에 안전하지 않았음
일회용 의료기기는 동일한 다회용(multiple-use) 의료기기를 이용하는 것보다 환자와 직원에게 위험이 더 높지 않다는 것을 보여줄 근거가 있을 때에만 재사용되어야 한다.
본 체계적 문헌고찰에서는 미국 FDA에서 현재 재사용되는 것으로 알려진 일회용 의료기기 목록에 있는 의료기기에 관한 평가는 접근 가능한 자료의 부족으로, 다양한 여러 종류의 의료기기의 재사용이 평가될 수 없었으며, 이들 의료기기들에 대한 안전성과 효과성에 대한 연구가 필요하다. 또한, 재처리 가능한 의료기기(예. 혈액투석막)일지라도 완전성(integrity)이 손상되기 전까지의 최대 재처리 횟수에 대한 연구도 필요하다.
4.2 FDA와 GAO 보고서 요약
의료기술평가 외에도 장기간 다기관에 걸쳐 재사용한 결과 위해가 증가하는 것이 발견되지 않았으므로 재처리과정을 거친 일회용의료기기의 재사용은 큰 문제가 없다는 관점도 있다. 미국은 2002년 재처리관련법이 강화되었고 FDA의 규정 및 관리 감독 및 부작용에 대한 보고체계가 강화되었다. 이렇게 축적된 자료에 대한 분석에서 제한점이 있는 자료들이긴 하지만, FDA는 재처리된 일회용의료기기가 건강의 위험을 증가시킨다는 것을 시사 할 만한 점이 없는 점을 감안할 때 더 엄밀한 테스트를 수행하는데 비용을 들이는 것은 자원 사용면에서 그다지 효율적이지 않다고 결론내리고 있다. 이에 대하여 2008년 미국회계감사원(GAO: government accountability office)은 FDA가 안전성관련 데이터 수집을 강화하였음에도 불구하고, 일회만 사용한 경우에 대비하여 재처리한 일회용 의료기기의 안전성에 대하여 결정적인 결론을 내릴만한 충분한 FDA 데이터나 연구들이 있지는 않았으며 FDA의 모니터링과 이러한 부작용 관련 데이터를 조사한 결과 FDA의 분석에 의문을 제시할 만한 점이 없음을 발견하였음을 밝혔다.
5. 사례연구 : 전기생리학적 진단용 카테터
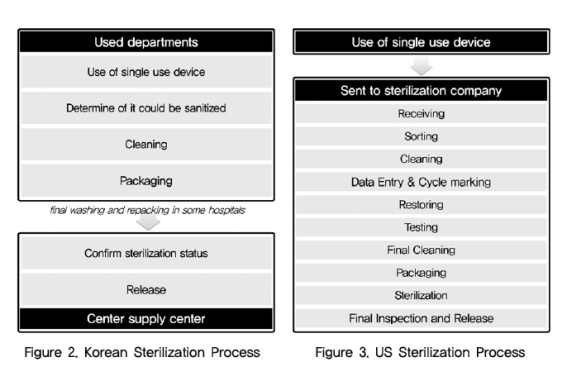
전기생리학적 진단용 카테터는 단위비용이 58만원~180만원으로 2008년 청구금액이 최소 77억 5,929만원, 최대 238억 4,721만원에 달하는 일회용 의료기기이다. 비교적 임상에서 재처리 후 재사용되고 있는 것으로 알려진 전기생리학적 진단용 카테터에 대한 미국 내 재처리 절차를 알아보고, 미국의 절차가 국내 의료기관에서 적용가능한지 알아보고자 하였다. 미국 내 재처리 절차는 FDA 및 재처리업체의 웹사이트를 통해 알아보았으며, 그림 3과 같았다. 이와 같은 절차의 국내 도입 가능여부를 알아보기 위해 종합병원 규모의 6개 의료기관을 방문 조사하였고, 이 중 인터뷰에 응하고 전기생리학적 진단용 카테터의 재처리를 하는 4개 의료기관에서 살펴본 결과, 미국의 재처리 절차의 국내 의료기관 도입은 어려울 것으로 판단되었다. 인터뷰 결과 현재 의료기관에서는 재처리 후 세척과 기능을 대부분 육안으로 판단하고 있으며, 재처리 후의 세척 타당성과 기능 타당성을 판단할 수 있는 기계 전기 화학적 검사의 시행이 의료기관내에서는 불가능하다는 답변을 얻었다. 미국과 국내 재처리 절차는 그림 2, 3에서 비교해볼 수 있다.

우리나라에서 일회용 의료기기의 전체를 재사용하였을 때의 경제적 이득은 일회용 의료기기의 시장 규모, 재처리 후 기능실패율과 같은 데이터의 부족, 다양한 품목별 재처리 가능회수, 인건비, 시설비용과 같은 재처리 비용의 다양한 차이 등의 이유로 현 시점에서 추정이 불가능하므로 한 품목을 정하여 사례연구로써 전기생리학적 카테터의 재사용으로 인한 비용절감 규모를 추정하였다. 외국의 자료를 이용하여 일회용 전기생리학적 진단용 카테터의 총사용횟수를 2회∼6회로 가정하여 비용최소화분석을 시행한 결과, 우리나라의 경우 한 해동안 24억-41억원의 비용절감을 기대할 수 있을 것으로 추정된다.
6. 사회, 윤리 및 법적 고찰
윤리적 문제를 다루는 일반원칙은 선행의 원칙, 악행 금지의 원칙, 자율성 존중의 원칙, 정의의 원칙이며, 의료기술평가 연구에 있어서 추가적으로 더 살펴보아야 할 원칙은 계약론적 관점(contractarianism), 공리주의적 관점(utilitarianism) 및 땅의 윤리(land ethic perspective)의 관점이다.
선행 및 악행금지의 원칙은 한번 사용할 용도로 제작된 의료기기를 재사용함에 따른 환자가 받게 될 불이익은 없는 지에 대한 논점이고 잠재적으로 감염 확률의 증가나 시술의 실패 확률 증가와 같은 위해는 없는지 의학적 근거를 살펴보아야 한다는 것이며 이는 앞서 4장에서 기술한 의료기술 평가 자료와 외국의 관련 보고서 검토를 통해 판단할 수 있다.
계약론적 관점은 상호 동의에 의해 의사결정이 이루어져야한다는 것이며, 재처리된 일회용의료기기를 환자에게 재사용하기 전에 환자 자신이나 보호자에게 동의를 받을 것인지에 대한 문제라고 볼 수 있다. 이에 대한 일반적 인 관점은 위해증가의 잠재성이 있을 경우에는 알리는 것이 마땅하나 위해의 증가가 없다면 환자나 보호자는 의료진에게 가장 좋은 선택을 일임하였으며 또한 환자에게 알림으로써 불필요한 불안감을 증가시킬 수 있으므로 알릴 필요가 없다는 것이다. 반면, 자신에게 사용될 의료기기가 새 것인지 재사용된 것인지를 알 권리가 있다는 주장도 있다. 재처리된 일회용 의료기기에 대해 사용 전 동의를 구하도록 요구하는 나라들은 스웨덴, 벨기에, 호주이며, 별다른 규정이 없는 나라들은 미국과 캐나다이다. 미국의 경우, FDA에서 일회용의료기기의 재처리과정에 대한 엄격한 기준을 요구하고 있으며 재처리된 의료기기가 시장에서 판매되도록 허가를 해주고 있으므로 일회용 의료기기를 처음 사용할 때와 마찬가지의 경우에 해당된다고 볼 수 있으며 환자의 별다른 동의를 받을 필요는 없다는 입장이다. 즉, 의사가 환자와 상의하는 것은 시술 자체에 대한 것이지 어떤 의료기기를 사용해서 시술한다는 점은 아니며 어떤 의료기기를 사용할 지에 대한 판단은 의료진이 해왔다는 점에서 시술에 대한 환자의 이해득실이 변하는 것이 아닌 한 알릴 필요가 없다는 논점이라고 볼 수 있다.
정의의 원칙에 대한 관점은 일회용의료기기의 재사용에 대한 사회적 제도 및 관리체계에 관한 점을 고려한 것이라고 볼 수 있다. 즉, 어떤 일회용 의료기기의 재처리를 허용할 것인지, 그리고 각 의료기기 별로 적절한 재처리과정에 대한 규정이라든지, 비용의 적절한 보상 또는 잠재적 위해 가능성을 추적 관찰하는 시스템이 존재하는지에 대한 것들이다.
공리주의적 관점은 의사결정에 따라 영향을 받는 전체에 총 이익이 가장 크게 돌아가도록 하자는 관점이며 이 관점에 따르면 의료기기의 재사용을 허용할 때 각 개인에 대한 잠재적 위해를 최소화 시키는 제도를 운영하면서 해당 사회가 얻을 이득이 무엇인지 고려해야한다는 관점이다. 이는 일회용의료기기의 재사용에 따른 경제적 이득 효과와 의료용 쓰레기를 얼마나 줄일 수 있는가에 해당되는 부분이며 후자의 경우, 우리의 의사결정이 개인에 국한된 점들만을 고려해서는 안 되며, 특히 지구환경에 대한 영향까지 고려해서 이루어져야한다는 땅의 윤리의 관점을 포함한 것이기도 하다.
7. 결론
이상으로 일회용의료기기의 재사용에 대해 의학적 근거와 각 나라별 제도 및 사회 윤리적 관점에 대한 고찰을 수행하였다.
각국 제도를 살펴본 결과 재사용을 금지하는 국가와 권고하지 않는 국가, 질적 관리 하에서 허용하는 국가, 그리고 공식적인 입장이 없는 국가로 크게 나누어 볼 수 있었다.
의학적 근거로써 두 가지 측면에서의 논점이 있음을 발견하였는데, 첫째로는 전통적 의료기술평가의 관점에서 일회용의료기기의 재사용한 것이 한번 사용하는 것에 비해 안전하고 효과 면에서 뒤떨어지지 않는가를 임상연구를 통해 입증하였는가하는 점이고, 두 번째로는 재처리된 일회용 의료기기를 사용하는 과정에서 발생하는 부작용에 대한 보고체계를 갖추고 장시간에 걸쳐 여러 기관에서 사용해온 결과 특별한 위해의 증가가 없으므로 문제는 없겠다는 관점이었다. 전자의 관점에 따르면 임상적으로 환자에게 사용되어 안전성과 효과성에 문제가 없음이 양질의 근거에 의해 입증된 의료기기는 혈액투석막 외에는 드물고, 임상적 연구가 더 필요하지만 엄격한 재처리 기준에 의하면 사용할 수 있겠다고 판단된 의료기기에는 전기생리학적 진단용 카테터, 트로카, 괄약근절개기, 외고고정창치 등이 있었다. 후자의 논점에 의하면 엄격한 재처리 규정을 제시하고 관리·감독하였으며 사후에 안전성에 대한 보고체계를 갖추어 제도화시킨 결과 환자에게 위해가 증가되는 증거는 없는 것으로 FDA와 미국 gao는 결론 내리고 있다.
국가 차원에서 일회용의료기기의 재사용을 허용할 것인지를 결정하는데 있어서는 환자에게 미칠 잠재적 위해의 정도와 이를 최소화하고 추적 관찰할 수 있는 사회적 시스템이 존재하는 지의 여부, 그리고 재사용에 따라 사회가 얻을 수 있는 이득의 규모 등과 같은 점들이 고려되어야 할 것으로 사료된다.
1. Introduction
Even though many Korean medical centers have been reusing single use devices after sterilization processing, there were no regulations or recommendations established by a legal legislative unlike countries like USA, Germany and Australia that allows the reuse of single use devices.
The issue of reusing single use devices has been brought up to the society’s attention when the reuse of disposable pain adjustment devices has aired on the news in 2003. From then on, the issues of hospitals billing the insurance for the use of single use devices when they have been reusing them have brought up to the society’s attention.
However, the insurances were also taking such conditions into their consideration and took the liberty of assuming the reuse of single use devices and applied such assumptions when calculating the costs paid out to the hospitals for using single use devices. Therefore, in order to prevent continuous loss of capital by using single use devices only once, the reuse of single use devices has become prevalent in the Korean medical practices.
In February 2009, Anti-Corruption and Civil Rights Commission has brought up the issue of "hospitals wrongfully billing the insurance for the use of new single use device when they are actually reusing them after sterilization". Not only that, but they went further and addressed the lack of Food and Drug Administration(FDA) regulations
to control the reuse of single use devices and the risk of relying solely on sterilization company’s standards. Also, they have addressed the existence of two opposing views from Korea Food and Drug Administration(KFDA) and the Ministry of Health, Welfare and Family Affairs regarding this matter. They also addressed the risk of "lethal secondary infections" from the reuse of single use devices and suggested "Regulations to control wrongful insurance billings for single use devices" to the congress to "define single use devices and prevent the reuse of single use devices".
The issue of reusing single use devices has been debated for 30-40 years in other countries as well. The first issue that has been debated regarding the establishment of regulations for reuse of single use devices has to do with increased infection rates and deterioration of device functions that leads to increased patient mortality and morbidity. Second issue had to do with increased medical costs due to frequent use of single use devices without reusing them. Finally, environmental issues regarding the disposal of single use devices have been debated in order to establish related regulations.
Therefore, this research is focused on reviewing the current policies regarding the reuse of single use devices, performing safety and effectiveness analysis on the reuse of single use devices and introducing legal, social and ethical issues to aid the establishment of national regulations regarding the reuse of single use devices.
2. Research Method
The major questions of this research are as the followings:
1. What are the policies in major countries for the reuse of single use devices?
2. Is the reuse of single use devices clinically effective and safe?
3. What are the social and ethical principles that must be
considered regarding the reuse of single use devices?
In order to answer above questions, the following methods have
been used to carry out the research.
First, extensive research on foreign reports and data regarding the reuse of single use devices has been performed to understand foreign policies and regulations.
Second, we performed the systematic review using previous systematic reviews to investigate the safety and efficacy regarding the reuse of single-use medical devices. To conduct research device we assessed the relevance and quality of four systematic reviews. We chose recently published and well-conducted systematic review as best availabl evidence and additionally investigated the primary articles published in Korean. Finally, we adopted the conclusion of AETMIS(Agence d'evaluation des technolgoies et des modes d'intervention en sante) Health echnology Assessment report as the best available evidence haemodialysis membrane, the findings of studies published in Korean were consistent with the results of AETMIS H. Our review as a comprehensive review using existing systematic reviews in methodology. Out of eighty six systematic
reviews searched from Ovidmedline, Embase, Cochrane library, CRD database, primary articles published since 2007, and 114 Korean primary researches searched from Koreamed and Kmbase, we selected one report that addressed the safety of reprocessed single-use medical devices, three reports that deals with safety and efficacy, and five Korean researches for the evaluation.
Two reviewers independently applied the selection criteria and the quality of the selected studies was evaluated independently by two reviewers using AMSTRAR tool and modified NHMRC assessment tool.
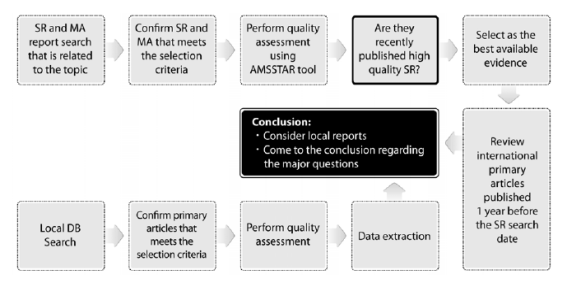
Third, review on FDA’s point of view on current safety and efficacy as well as related GAO report has been performed to confirm the safety and efficacy of reusing single use devices.
Fourth, interviews have been performed to confirm whether or not current Korean medical centers are able to perform sterilization processes that abide to strict FDA regulations.
Finally, reviews on medical technology evaluation reports as well as other reports that deal with social and ethical issues regarding the reuse of single use devices have been performed.
3. International Status
There are various views from different countries regarding the reuse of single use devices. Each country’s policies are different based on each nation’s medical system as well as their views on the safety of reusing single use devices. However, even though the policies may differ, they all agree on the basic principle that the patient’s safety comes first before any other values. The national policies regarding the reuse of single use devices may be grouped to four large categories. The first category is the countries that allow the reuse of single use devices under strict sterilization regulations. The second category is the countries that bans or not recommends the reuse of single use devices for safety purposes. Finally, there are some countries that do not have a legislation on the reuse of single use devices even though reuse of single use devices is prevalent in their countries. (Table 1)
|
Banned |
Not recommended |
Accepted under high
quality standards |
No legislation but
performed |
|
France
(Recommendation),
Spain, Austria,
Portugal, Canada
(Manitoba and
Northwest State) |
UK,
Hungary, Canada
(New Brunswick,
Ontario, British
Columbia), Italia,
Switzerland |
Germany, USA,
Australia,
Denmark,
Sweden, Belgium,
Norway,
Netherlands,
Canada (Quebec) |
Singapore, Japan,
Taiwan,
Greece, New
Zealand, Poland,
Finland |
Countries that ban the reuse of single use devices are France, Spain and Austria. In the case of France, there is no ban against the reuse of single use devices. However, government’s strong recommendations against the use of single use devices prevent French medical centers from reusing single use devices. Similar to France, UK also strongly recommends medical centers not to reuse single use devices after the preliminary use. It is the UK government’s view that there is lack of systemic review on the safety and efficacy of reusing single use devices after the preliminary use. Therefore, the government feels that patients are exposed to unnecessary risks when the medical centers reuse single use devices. In the case of Canada, different province have different views on this matter. Countries like Singapore, Japan and Taiwan do not have a formal opinion that has been imposed on the national medical society to regulate the reuse of single use devices. Countries that have decided that the reuse of single use devices is safe as long as a strict quality control system is imposed upon the medical society allows by law to reuse single use devices. USA, Germany and Australia are the examples. Germany allows the reuse of single use devices as long as the medical centers go through the authorized standard procedure. Germany has imposed the Robert Koch Institute Recommendations regarding the sterilization process of used single use devices to control their medical society. Also,
Australia allows the reuse of single use devices as long as the medical centers abide to their TGA guidelines.
In United States, since the introduction of Medical Device User Fee and Modernization Act(MDUFMA) in 2002, it has been tweaked until 2006. This regulation forces sterilization companies to register as medical device sterilization companies in USFDA and submit the list of medical devices that they wish to handle. Also, the sterilization company must be able to report adverse effects from reusing single use devices, follow up on sanitized medical devices, control quality based on cGMP and perform labeling as well as validation in order to be approved as a medical device sterilization company. Only the single use devices that have been notified for its reuse before being launched in the market (510k) are allowed to be reused for medical purposes as well.
4. Basis for the Safety and Efficacy of Reusing Single use Devices
4.1 Evaluating Medical Technology
Conclusion regarding the clinical efficacy of reusing single use devices has been drawn up from NZHTA(New Zealand Health Technology Assessment) report published in 2004 and CADTH(Canadian Agency for Drugs and Technologies in Health) published in 2008 in combination with health technology assessment report from AETMIS(Agence d'evaluation des technolgoies et des modes d'intervention en sante) published in 2009.
Additionally, we selected five Korean researches on the reuse of hemodialysis membrane(dialyzer) and the disposable blade in automated microkeratome. The results of the safety and efficacy of reprocessed hemodialysis membrane consisted with previous AETMIS report. In primary studies published since 2007, ultrasound catheter, Arthroscope shaver blade/abrader, and nasopharyngoscope sheaths were examined to identify the safety after reprocessing.
Based on 2009 AETMIS conclusions, we evaluated 19 single-use medical devices (15 critical medical devices and 4 semi-critical medical devices) and categorized them into the following groups to provide the evidence for their safety and efficacy after reprocessing of its single use.
|
Medical Devices |
Evidence |
|
critical |
PTCA catheter |
b |
|
Balloon catheter |
c |
|
Electrophysiology catheter for diagnostic purposes |
b |
|
Central vein catheter |
c |
|
Disposable angioscopy |
c |
|
Argon beam coagulation detector |
c |
|
Perfusion cannula |
c |
|
Disposable plastic trocar / disposable laparoscope
devices |
b |
|
Dialyzer |
a |
|
Sphincterotome |
b |
|
Phacoemulsification needle tip |
c |
|
Forceps for biopsy |
d |
|
Disposable blade for micro-cornea incision |
c |
|
Ultrasound catheter (AcuNav- catheter) |
c |
|
Arthroscope shaver blade/abrader |
c |
|
semi-critical |
Components of orthopedic external fixator |
b |
|
Breathing circuit filter |
c |
|
Artificial airway/ Bronchoscope stopcocks |
c |
|
nasopharyngoscope sheaths |
c |
A : there is sufficient evidence to conclude that it is safe and effective to reuse single-use medical devices
B : There is sufficient laboratory evidence that support the safety of reusing these single use devices. However, it needs well designed clinical trial in human.
C : In small number of scientific studies, they had low level of evidence conducted in vitro nature of these studies.
D : All of studies conducted in vitro may not be safe after being reprocessed.
Single-use medical devices must be recycled only if there is sufficient amount of evidence that supports that reuse after reprocessing does not increase the risk in any ways for the patients as well as the hospital staffs compared to the use of multiple-use medical devices.
There is a lack of data to evaluate the safety and efficacy of reprocessing and reuse of devices labeled single-use enlisted in FDA. Therefore, we need to perform the researches to demonstrate that device integrity remains substantially equivalent to its predicate device after a maximum number of times of reuse.
4.2 Summary on FDA and GAO Report
There are some perspectives that argue the reuse of single use devices is safe because there are no reported serious complications despite its prevalence around the globe. US Regulations and laws regarding this matter have been strengthened in 2002 as well as FDA regulations on monitoring and reporting the complications that may have occurred from reusing single use devices. Even though the data that has been collected through these regulations has its limitations, FDA has concluded that there are no significant evidences that support the increase of risk due to reuse of single use devices; thus not cost-effective to perform detailed tests on this matter. In 2008,
Government Accountability Office (GAO) has noted that despite of FDA’s efforts to collect data related to the safety of reusing single use devices, there are insufficient amount of data and research that allow FDA to conclude the reuse of single use devices are not as safe and efficient as the initial use of single use devices. Also, they have added that there are no questions aroused from FDA’s monitoring and complication analysis methods.
5. Case Study : Electrophysiology Catheter for Diagnostic purposes
Electrophysiology catheter is a single use device that costs 580,000 ~ 1,800,000 Wons per piece and was billed for 7,759,290,000 ~ 23,859,290,000 Wons to the insurance in 2008. In this research, the study on US sterilization processes for the reuse of Electrophysiology catheter has been performed to evaluate whether or not it could be applied to the Korean medical system. The sterilization processes has been researched from USFDA and sterilization company’s websites and are as shown in picture 3. In order to determine whether or not this method could be applied to the Korean medical system, six major Korean medical centers have been interviewed and four medical centers have been visited to observe their sterilization processes. From this research, it has been determined that it would be difficult to implement US sterilization processes to the Korean medical centers. Currently, the Korean medical centers are relying on eye-inspections to determine the efficacy of sterilization process and replied that it would be impossible to implement electrochemical tests to determine the efficacy of their sterilization processes. The comparison of US and Korean sterilization processes are as shown in Figure 2 and 3.
When all of the single use devices are reused, it would be impossible to estimate the economical benefits from it due to variable factors that play its role such as: scope of market for reused single use devices, lack of data on inefficacy of sterilization processes, maximum number of use before the device looses its integrity, labor cost and facility costs. Therefore, the reuse of Electrophysiology catheter has been selected as a case study to estimate its economical benefits. When the calculation assumes that the maximum reuse frequency of Electrophysiology catheter is two to six times based on international researches, Korean insurance should be able to save 2.4 ~4.1 billion Wons from reusing Electrophysiology catheter.
6. Social, Ethical and Legal Considerations
The basic principles that deal with ethical issues are the principle of beneficence, principle of non-maleficence, principle of respect for autonomy and the principle of justice. Additionally, contractarianism, utilitarianism and land ethic perspective must be considered as well.
The principle of beneficence and non-maleficence deals with the potential risk of patients due to the reuse of medical devices designed for a single use only. Evidences for such perspectives may be obtained from medical technology evaluation data and international researches provided in articles 4.
From contractarianism’s point of view, the agreement to reuse single use devices must be made by both parties thus requires consent from the patient before its reuse. Normally, when there is a risk of danger, it is normally accepted for the physicians to provide the patients with necessary information. However, when there is no evident risk for reusing the medical device, there is no need to increase the patient’s anxiety by providing unnecessary information because the patient has granted the doctors with right to make decisions based on the patient’s best interests. However, some may argue that the patients have the right to know whether or not the medical devices are being reused or not. Countries like Sweden, Belgium and Australia require patient consent before reusing sterilized single use devices. However, there are no such regulations in place in USA and Canada. In the case of United States, US FDA has implemented strict regulations regarding the process of single use devices before being reused. After the devices have been sterilized to FDA standards, those devices may be sold in the market with FDA approval. Since both new and sterilized single use devices have FDA’s approval to be sold in the market, USFDA argues that there is no need for patient’s consent in reusing sterilized single use devices. In other words, as long as the doctors act on the patient’s best interest, they are obligated to explain and receive consent for the medical procedures but not obligated to inform and receive consents for the medical devices used during the procedures.
The principle of justice deals with social regulations and management systems regarding the reuse of single use devices. In other words, it deals with the existence of regulation for controlling the sterilization processes, follow-up system for potential risks and possible compensations in the case of accidents.
The utilitarianism perspective deals with the overall benefit made from the decision of allowing the reuse of single use devices. According to this perspective, there is a need to minimize individual risks for reusing medical devices while considering the social benefits that could be created from it. In other words, economical benefits as
well as the benefits from reducing medical garbage must be considered along with social and environmental benefits to include the land ethic perspectives.
7. Conclusion
This research has reviewed medical evidences of reusing single use devices and different country’s policies regarding this matter as well as social and ethical perspectives.
Medically, there are two contrasting perspectives. The first perspective argues that there are not enough clinical evidences to support that the reuse of single use devices are as safe as the initial use of single use devices. The second perspective argues that there are no concrete evidences to say that the reuse of single use devices increase the risk for both patient and physicians despite the enforced system that makes medical centers to report complications aroused from reusing single use devices. From the former’s perspective, Dialyzer is the only single use device that may be reused based on concrete evidences to support its safety and efficacy even after the initial use. Also, it recommends the reuse of Electrophysiology catheter, trocar, sphincterotome and orthopedic external fixator only when there are extensive regulations on their sterilization processes in place. The latter perspective, taken by USFDA and GAO, argues that after implementing an extensive system that both monitors the reuse of single use devices and controls their complications, it can be concluded that there are no evidences that support the increased risk for patients due to reusing single use devices.
Therefore, this research concludes that there is an essential need to consider the potential danger to patients, existence of follow up system for reused single use devices and the scope of social benefits before determining the national policy on reusing single use devices.

 · 저작자표시
· 저작자표시 · 출처표시
· 출처표시























 한국보건의료연구원
한국보건의료연구원